窒素(ちっそ、英: nitrogen、仏: azote、独: Stickstoff)は、原子番号7の元素である。元素記号はN。原子量は14.007。第15族元素、第2周期元素。
地球の大気中に安定した気体として存在するほか、生物に欠かせないアミノ酸、アンモニアなど様々な化合物を構成する。ハーバー・ボッシュ法によりアンモニアの量産が可能になって以降、人間により工業的に産生された窒素肥料や窒素酸化物が大量に投入・排出され、自然環境にも大きな影響を与えている。
一般に「窒素」という場合は、窒素の単体である窒素分子()を指すことが多く、本項でもそのように用いられる場合がある。本項では窒素分子についても記載する。
名称
1772年に、ダニエル・ラザフォードが noxious air(有毒空気)と名付けた。その中に生物を入れると窒息して死んでしまうことにちなんでいる。
カール・ヴィルヘルム・シェーレは、酸素を「火の空気」、窒素を「駄目な空気」と命名した。
アントワーヌ・ラヴォアジエは、フランス語で「生きられないもの」という意味のazoteと命名した。
窒素の英語名「nitrogen」は、ギリシア語のνίτρον(硝石の意)とγεννάω(「生じる」の意)に由来している。
ドイツ語ではSticken(窒息させる)とStoff(物質)を組み合わせてStickstoffと呼ばれており、日本語の「窒素」は、これを訳したものである。
歴史
窒素は、かつて物が燃えるもとと考えられていた燃素の研究の過程で発見されたもので、最初に単体分離を行った者の特定は困難である。
1772年、ダニエル・ラザフォードが窒素を単体分離(窒素分子)した。
ほぼ同じ時期にカール・ヴィルヘルム・シェーレとヘンリー・キャヴェンディッシュも単体分離(窒素分子)したと言われている。
窒素が元素であることを発見したのはフランスのアントワーヌ・ラヴォアジエである。
近年の需要に対応して、窒素分子気体について2005年に日本工業規格(JIS K 1107)に規定の純度が高められた。
分布
窒素は窒素分子として空気の大部分(容積比で78.11%、重量比で75.53%)を占め、その他にもアミノ酸をはじめとする多くの生体物質中に含まれており、地球のほぼ全ての生物にとって、必須の元素である。
オーロラが起きる場合、窒素は赤、青、紫色の光を放出する。
窒素を主体とする大気は地球のほかに、土星の衛星であるタイタンも保持している。タイタンの大気は地球よりも濃密であり、気圧は地球の1.5倍にも上るが、その大気の97%は窒素によって占められている。
性質
窒素は窒素族元素の一つ。生物にとっては非常に重要でアミノ酸やタンパク質、核酸塩基など、あらゆるところに含まれる。これらの窒素化合物を分解すると生体に有害なアンモニアとなるが、動物(特に哺乳類)は窒素を無害で水溶性の尿素として代謝する。しかし、貯蔵はできないためそのほとんどは尿として体外に排泄する。そのため、アミノ酸合成に必要な窒素は再利用ができず、持続的に摂取する必要がある。
ただし、窒素分子は非常に安定した分子であるためにほとんどの生物は大気中の窒素分子を利用することができず、微生物などが窒素固定によって作り出す窒素化合物を摂取することで体内に窒素原子を取り込んでいる。こうした窒素化合物はやはり微生物による脱窒の過程を経て再び大気中に放散され、窒素循環と呼ばれるサイクルを形成している。
窒素分子
窒素分子は化学式 で表され、常温常圧で無色無臭の気体として存在する。分子量28.014、融点−210 °C、沸点−195.8 °C、比重0.808(−195.8 °C)。地球の大気中に最も多く含まれる気体で、大気中の体積分率は地上でおよそ78%である。
窒素分子は常温では無味無臭の気体として安定した形で存在する。また、液化した窒素分子(液体窒素)は冷却剤としてよく使用される。常圧では、窒素分子の沸点は−195.8 °C、77 Kである。
常温常圧下では極めて不活性かつ、アルゴンなどの希ガスに比べると安価な気体であるため、嫌気性条件や乾燥条件を設定する際に、用いられることが多い。
1964年、山本明夫らのグループによって、窒素分子のコバルト錯体(山本錯体、パールハーバー・コンプレックス)が報告されている。このテーマは、森美和子らによって、窒素分子を活性化して有機化合物に組み込む研究に発展した。なお、2004年になって窒素を1700 °C、110万気圧で圧縮することにより、窒素原子が3本の腕で蜂の巣状のネットワーク「ポリ窒素(polynitrogen)」を作ることが判明した。このポリ窒素は、核兵器を除いた中では最大の威力を有する爆薬に比べて4倍以上のエネルギーを有すると考えられている。
雷(落雷)に付随して発光すると言われる超高層雷放電(レッドスプライト)は窒素分子がその発光に関係していることが分かった。
窒素分子の用途
窒素は工業分野では幅広い用途に使われている。また窒素単体だけでなくその化合物も様々な用途に広く使用される。窒素化合物を生産する工業は「窒素工業」と総称され、化学工業の重要な一分野となっている。
- ハーバー・ボッシュ法によるアンモニア生産の原料。
- 冷却剤(液体窒素) - 液体窒素温度(−195.8 °C)まで冷却でき、安価で比較的安全なため、低温における化学および物理学の実験、オーバークロック競技などでのCPUの冷却、工業用プラント、受精卵の凍結保存、爆発物処理などの冷却に用いられる。
- 食品の酸化防止のための封入ガス。
- テクニカルダイビング用呼吸ガス(ナイトロックスやトライミックスなど混合ガス)。
- 消火器の加圧粉末式・蓄圧粉末式の圧力源。
- 不活性ガスとしての特性を生かし、タイヤやアキュムレータにも使用されている。
- ゴムタイヤへの充填では、空気に比べて乾燥しているため、急激な温度変化にさらされる航空機用では内部の凍結や結露を防ぐことができ、かつ、モータースポーツなどの過酷な条件下でも温度に対する内圧の変化が少ない。一般的な自動車での使用でも(タイヤ内部に酸素遮断膜はあるものの)ゴムを透過しやすい酸素を含まないため抜けにくくなる利点がある。
窒素ガスの2004年度の日本国内生産量は90億5897万8000立方メートル、工業消費量は35億9448万立方メートル、液化窒素の2004年度日本国内生産量は22億2227万立方メートル、工業消費量は3億6105万1000立方メートルである。
窒素と植物
植物にとって窒素は、たんぱく質や葉緑素をつくり生育を促す不可欠な要素である。そのためリン酸、カリウムと並んで肥料の三要素の一つに数えられる。特に葉を大きくする作用が強いため、窒素は葉肥と呼ばれる。
窒素不足になると葉の黄変や葉枯れを起こすことがある。一方、窒素過多になると、葉は濃緑色になり、開花が遅れたり咲かないことがある。
窒素化合物
窒素化合物には、アンモニアや硝酸のような無機化合物から、各種ニトロ化合物や複素環式化合物などの有機化合物まで、非常に多くの種類がある。
20世紀以降、大量の窒素化合物が人為的に生産・排出されるようになり、酸性雨を含む大気汚染、水系の富栄養化、地下水の硝酸汚染を引き起こしており、微生物や触媒による窒素の回収・再利用技術が日本の産業技術総合研究所で研究されている。
以下では主に無機化合物について概説する。
窒素酸化物
窒素と酸素からできる化合物を窒素酸化物という。略称NOx(ノックス)で、大気汚染の原因物質の一つとされるが、窒素と酸素を混合して高温に加熱すると自然と生成するため、排出の抑制は難しい。
- 一酸化二窒素(亜酸化窒素、笑気)()
- 一酸化窒素()
- 三酸化二窒素()
- 二酸化窒素()
- 四酸化二窒素()
- 五酸化二窒素()
- 三酸化窒素(中国語: 三氧化氮)()
窒素のオキソ酸
窒素のオキソ酸は慣用名を持つ。次にそれらを挙げる。
※オキソ酸塩名称の'-'にはカチオン種の名称が入る
- 亜硝酸アミル
窒化物
窒化物(ちっかぶつ)とは、窒素と窒素よりも陽性の(電気陰性度が小さい)元素から構成される化合物である。場合によってはアジ化物も含める場合もある。
- 窒化ホウ素 ()
- 窒化炭素 ()
- 窒化ケイ素 ()
- 窒化ガリウム ()
- 窒化インジウム ()
- 窒化アルミニウム ()
- 窒化マグネシウム ()
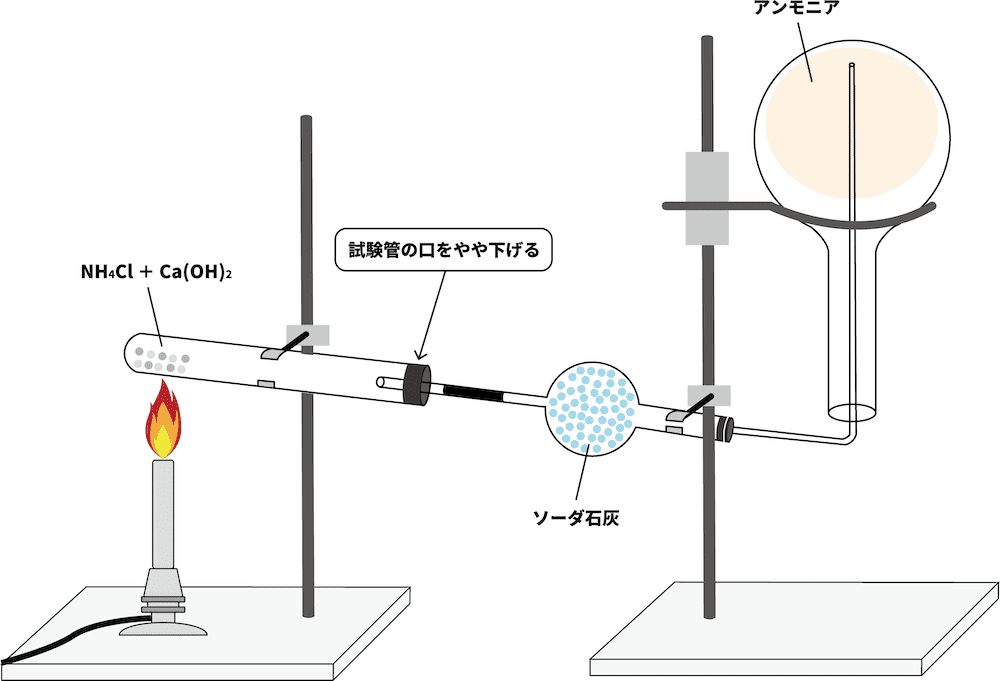
- アンモニア ()
その他の窒素化合物
- 三フッ化窒素 ()
- 三塩化窒素 ()
- 三臭化窒素 ()
- 三ヨウ化窒素 ()
- クロラミン () , ()
- ヒドロキシルアミン ()
同位体
脚注
注釈
出典
関連項目
- 窒素飢餓
- 窒素酔い
- ハーバー・ボッシュ法
外部リンク
- 『生産動態統計年報 化学工業統計編』経済産業省
- 『窒素』 - コトバンク

![窒素 元素記号のイラスト素材 [107097239] PIXTA](https://t.pimg.jp/107/097/239/5/107097239.jpg)

![窒素の分子式と構造式は?窒素の質量と密度[g/cm3]や分子量の計算方法【1立方メートルの重さ】|白丸くん](https://white-circle7338.com/wp-content/uploads/2019/12/窒素の分子式.jpg)